

DOI: https://doi.org/10.37811/cl_rcm.v8i1.9499
Fármacorresistencia
en Especies de Candida sp. Causantes de Infecciones Fúngicas Invasivas en Latinoamérica
Revisión Sistemática
RESUMEN
Objetivo: sistematizar la
información sobre la distribución de especies y la farmacorresistencia de levaduras
del género Candida sp. causantes de infecciones invasivas en Latinoamérica, a
partir de una revisión sistemática de artículos publicados desde 2012 a 2023. Metodología:
se realizó una revisión sistemática siguiendo las recomendaciones PRISMA para sistematizar
información de calidad sobre la frecuencia, diversidad y nivel de resistencia
de las especies que predominan en Latinoamérica. Se emplearon las bases de
datos de Scopus, Pubmed y Scielo para identificar las publicaciones a través de
palabras claves y operadores booleanos, desde el 2012 hasta 2023. Resultados:
se identificaron 57 reportes de diferentes países de la región, con un total de
28 especies, siendo las más frecuentes a C. albicans, C. parapsilosis, C.
tropicalis y C. glabrata con diferencias por países y dentro de cada país o
institución analizada. En la región la resistencia a los derivados azólicos fueron
las más frecuentes, con una gran variabilidad entre especies, pero con C.
glabrata como el organismo con mayor incidencia. Conclusiones: en la región hay
una gran variedad de Candida sp. causantes de infecciones invasivas comparable
a otras zonas del mundo, de las cuales, se debe prestar mucha atención a la
evolución de la resistencia antimicótica de C. glabrata.
Palabras
clave:
candidemia, candidiasis invasiva, resistencia fúngica a fármacos
Drug
Resistance in Candida sp. Species Causing Invasive
Fungal Infections in Latin America A Systematic Review
ABSTRACT
Purpose: systematize
information on species distribution and drug resistance of Candida sp. invasive
infections in Latin America, based on a systematic review of articles published
from 2012 to 2023. Methodology: a systematic review was carried out following
PRISMA recommendations to systematize quality information on the frequency,
diversity and level of resistance of the species that predominate in Latin
America. The Scopus, Pubmed and Scielo databases were used to identify
publications through keywords and Boolean operators, from 2012 to 2023.
Results: 57 reports from different countries in the region were identified,
with a total of 28 species, the most frequent being C. albicans, C.
parapsilosis, C. tropicalis and C. glabrata with differences by country and
within each country. analyzed institution. In the region, resistance to azole
derivatives was the most frequent, with great variability between species, but
with C. glabrata as the organism with the highest incidence. Conclusions: in
the region there is a great variety of Candida sp. causing invasive infections
comparable to other areas of the world, of which, close attention should be
paid to the evolution of antifungal resistance of C. glabrata.
Keywords: candidemia, invasive
candidiasis, fungal drug resistance
Artículo recibido 20
diciembre 2023
Aceptado
para publicación: 22 enero 2024
INTRODUCCIÓN
Las
candidiasis invasivas (CI), infecciones causadas por levaduras del género Candida
sp., se consideran un problema de salud creciente en Latinoamérica. Su
principal forma de presentación son las candidemias (infecciones en el torrente
sanguíneo), aunque también se encuentran infectando estructuras internas que
previamente eran estériles como el abdomen (abscesos), el peritoneo
(peritonitis) o el hueso (osteomielitis), entre otras (Pappas
et al., 2018; Riera et al., 2022).
La
incidencia de CI en Latinoamérica oscila entre 0.3 a 6.0 casos por cada 1000
admisiones hospitalarias, con una mortalidad entre 30 % al 76 %, dependiendo
del país, e incluso de la zona geográfica en la que se enclave el estudio (da Matta et al., 2017; Nucci et al., 2013). Los
pacientes con una estadía prolongada en unidades de cuidados de pacientes
críticos, el uso de nutrición parenteral, de catéter venoso central, o de
antibióticos de amplio espectro por largos periodos o con frecuencia, se
encuentran entre los principales factores que justifican estas altas tasas (Riera et al., 2022).
Desde hace
varias décadas, la especie predominante en Latinoamérica es C. albicans;
no obstante, en los últimos años se ha observado también una elevada frecuencia
otras cepas, entre las que destacan C. parapsilosis, C. tropicalis y
C. glabrata (da Matta et al., 2017; Riera et al.,
2022), lo que podría sugerir un cambio epidemiológico regional. En tal
sentido, en una investigación previa en población general (0-98 años) de siete
países con 21 hospitales participantes, ya había mostrado que estas tres
especies representaban el 50.4 % del total de aislamientos (Nucci et al., 2013).
A pesar de
lo anterior, los estudios multicéntricos propios de cada país dan un panorama
epidemiológico con diferencias significativas. En este sentido, mientras en
Argentina (Tiraboschi et al., 2017; Vigezzi et al.,
2019) o en la región norte de Brasil (Spina
Canela et al., 2017) se reportan frecuencias de C. albicans que
superan el 40 %, en otros, como en Perú (Rodriguez et
al., 2017), Honduras o Venezuela (Nucci et
al., 2013), apenas sobrepasa el 25 %. Las razones de estas discrepancias
no se comprenden aún, pues podrían deberse a múltiples factores
epidemiológicos; sin embargo, algunos autores proponen que esto pudiera
asociarse con las prácticas de profilaxis antifúngica y el consecuente aumento
de cepas resistentes, así como de los recursos disponibles para prevenir tales
infecciones en las instituciones de salud, entre otros (da
Matta et al., 2017).
La
disponibilidad de estudios recientes que sistematicen la información disponible
sobre la distribución de especies y la frecuencia de resistencia a los
antifúngicos en Candida sp. son limitados en Latinoamérica. Se destaca
así el trabajo de da Matta et al. (da Matta et al.,
2017), el cual, después de revisar críticamente 40 investigaciones de la
región, concluyó que existía un cambio epidemiológico en la frecuencia de
presentación de especies no albicans, algunas de las cuales no solo
aumentan su frecuencia, sino que muestran patrones de resistencia a algunos
tratamientos de primera línea. Por ello, el objetivo general de este trabajo es
sistematizar la información sobre la distribución de especies y la
farmacorresistencia de hongos del género Candida sp. causantes de
infecciones invasivas en Latinoamérica, a partir de una revisión sistemática de
artículos publicados desde 2012 a 2023.
MÉTODOS
Estrategia
de búsqueda
La revisión
sistemática se realizó siguiendo las recomendaciones PRISMA (Page et al., 2021). Se utilizaron las bases de
datos de Pubmed, SCOPUS y Scielo, así como referencias
cruzadas en los artículos. La búsqueda inicial se delimita a los trabajos
publicados entre 2012-actualidad. Las sentencias de búsqueda variaron según la
base de datos, pero en todos los casos se hizo con operadores booleanos y la
combinación de palabras claves como se ve en el siguiente ejemplo: (candidemia
or "invasive candidiasis" or "invasive candida" or
"invasive fungal infection" or "candida species") and
("antifungal susceptibility profile" or fluconazole or voriconazole
or micafungin or anidulafungin or Amphotericin or Caspofungin or Flucytocine)
and ("latin america" or Argentina or Brazil or Chile or Paraguay or
Uruguay or Bolivia or Peru or Ecuador or Colombia or Venezuela or Panama or "Costa
Rica" or Honduras or "El Salvador" or Nicaragua or Guatemala or
México or "Republica Dominicana" or Cuba or "Puerto Rico"). Dos
investigadores por separado llevaron a cabo la selección y evaluación posterior
de los trabajos obtenidos.
Criterios
de selección de los estudios
Inicialmente
se procede a eliminar manualmente los reportes duplicados, lo que se hizo en
una hoja de cálculo de Excel. Posteriormente se aplican los criterios para
seleccionar los trabajos que se revisarían para determinar su inclusión en esta
investigación:
Inclusión: se incluyen todos los
trabajos que una vez revisados el título, resumen y palabras clave, estuvieran
en idiomas español, inglés o portugués, con o sin el perfil de susceptibilidad
a antifúngicos, publicados entre 2012 e inicios de 2023. Los trabajos debieron
incluir una muestra superior a los 20 aislamientos identificados hasta nivel de
especie para tener un máximo de países representados. Identificados estos
documentos, se pasó a su localización y descarga.
Exclusión: se descartaron los
trabajos sin acceso completo y que los autores no respondieron a las
solicitudes de copias. Asimismo, una vez descargados, se excluyeron las
revisiones bibliográficas, los reportes de casos aislados o de una sola
especie, los estudios caso-control, estudios en animales, con muestras que no
proceden de candidiasis invasivas o que estas no estuvieran incluidas, los que
no son de la región o están escritos en otro idioma. También se eliminaron los
trabajos con un pobre diseño metodológico, evaluados por separado por dos
revisores solventando las discrepancias a través de reuniones de consenso. En
el caso de trabajos que abarcaran múltiples países (multinacionales), siempre
que fue posible se separó la información por países para su análisis.
Extracción
de los datos
Definidos
los artículos elegibles y con acceso completo, se pasa a la recopilación de los
datos de interés. Un autor extrajo la información en una hoja de Excel
considerando los siguientes aspectos: autores, año de publicación, población,
país, periodo en el que seleccionó la muestra, número de aislamientos, total de
centros/países implicados, métodos de identificación de las especies, métodos
de evaluación de la susceptibilidad a antifúngicos, distribución de especies,
perfil de susceptibilidad. Una vez concluido el proceso otro autor valida la
información, revisando si se requieren elementos adicionales para garantizar el
cumplimiento de los objetivos. Cualquier discrepancia se resuelve mediante
debate.
Síntesis
de resultados
Para la
elaboración del documento final se empleó la lista de verificación recomendada
por PRISMA para las revisiones sistemáticas y metanálisis (Page et al., 2021). Debido a la variabilidad de
diseño y métodos diagnósticos empleados en los estudios, se decide realizar un
análisis cualti-cuantitativo empleando la mediana de las frecuencias relativas
de presentación de cada especie de Candida sp., así como de la
resistencia a los diferentes antifúngicos. De esta forma, se presentan los
resultados en tablas que describen el tipo de estudio, tamaño muestral, tipo de
métodos de identificación, frecuencia de cada especie, entre otros, para
describir cada trabajo incluido en la investigación. Asimismo, se presenta una
tabla delimitando las especies identificadas en cada país como una medida
indirecta de la diversidad de Candida sp. que permite la comparación
cualitativa entre países y de la región con otros países del mundo. Por último,
se presentan en gráficos una síntesis de la mediana de la frecuencia global por
país de las especies más frecuentes.
Análisis
del riesgo de sesgo
Para el
análisis del riesgo de sesgo se utilizó la herramienta Critical Appraisal
Checklist for Case Series del Instituto Joanna Briggs (Joanna Briggs
Institute – JBI)(Munn et al., 2020), al
ser la que más se ajusta a las características metodológicas de los trabajos
evaluados. Asimismo, el riesgo de sesgo se evaluó con las recomendaciones de
Yamin et al. (Yamin et al., 2022),
considerando que si cumple los requisitos con < 49%, el riesgo es alto,
entre 50 % y 69 % es moderado, 70 % o más es bajo. El procesamiento y
presentación de los resultados de este análisis se hizo con ayuda de la
herramienta Review Manager 5.4 (RevMan) de Cochrane.
RESULTADOS
Descripción
general de los estudios incluidos
De los 708
artículos inicialmente identificados, se incluyeron 52 con un total de 57 reportes
de trece países latinoamericanos. De estos trabajos, 35 aportaron información
sobre estudios de susceptibilidad antifúngica (Figura 1). El 48 % de los
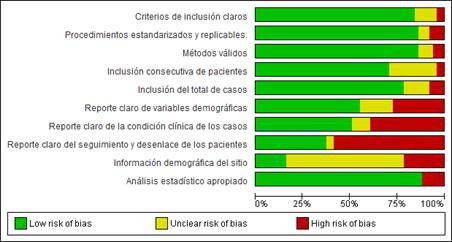
trabajos incluidos mostró un bajo riesgo de sesgo y los demás, un riesgo
moderado. La falta de información demográfica sobre los sitios donde se
desarrollaron los estudios y del seguimiento a los pacientes fueron los
principales factores que afectaron el riesgo de sesgo en la muestra analizada
(Figura 2).
Figura
1.
Proceso de selección de los trabajos.

Figura
2.
Riesgo de sesgo según los criterios empleados
La mayoría de
los reportes fueron de Brasil (n = 18; 32 %), seguido en menor medida por
Colombia, Argentina y México con seis estudios cada uno. Otros países
presentes fueron Perú, Venezuela, Chile, Cuba, Costa Rica, Paraguay, Honduras,
República Dominicana y Ecuador. La mayoría de los trabajos se publicó antes del
2017, con muestras obtenidas antes entre 1995 y 2016 (ver más información en la
Tabla 1.)
En cuanto a
las instituciones, el 45 % (n=25) de los estudios fueron multicéntricos, con
dos o más hospitales o centros de salud de tercer o cuarto nivel participantes.
Además, cuatro pesquisas se realizaron en población exclusivamente pediátrica y
neonatal, dos en población mayor de 12 años, uno en mayores de 15 años, cuatro
en mayores de 17 años, y el resto en población general desde 0 años hasta
adultos mayores. La incidencia o prevalencia de candidiasis invasiva, se ubicó
entre 0.33 a 6 casos por 1000 ingresos (mediana: 1.72 casos/1000 ingresos),
siendo mayor en los pacientes ingresados en salas de cuidados críticos.
Distribución
de especies de Candida sp.
En total se
identificaron 28 especies en la región, utilizando fundamentalmente métodos
bioquímicos y morfológicos, seguido de métodos moleculares (amplificación de
regiones del ADN y secuenciación) y otros de identificación proteómica como
MALDI-TOF.
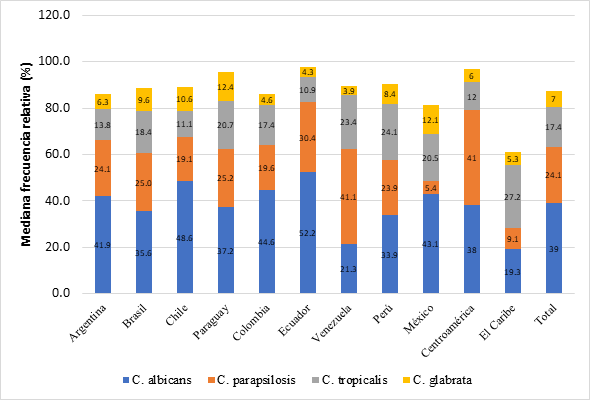
En la
mayoría de los países la especie predominante fue Candida albicans, con
una frecuencia superior al 30 %. Como excepciones se tuvo a Venezuela y a los
países de Centroamérica (Honduras y Costa Rica), donde predominó C.
parapsilosis, así como a los países de El Caribe (Cuba y República
Dominicana) con C. tropicalis. Las especies Candida no albicans
más frecuentes fueron C. parapsilosis, C. tropicalis y C.
glabrata, en ese orden (Figura 3). Otras cepas observadas en la
mayoría de los trabajos fueron: C. guilliermondii, C. krusei, C.
lusitaniae, C. famata y C. pelliculosa, C. kefyr, C. haemuloni,
C. lipolytica, C. dubliniensis,C. rugosa, C. intermedia, C. utilis, C.
orthopsilosis, C. metapsilosis, C. duobushaemulonii. Por último, destacar
aquellas cepas que fueron detectadas en un solo país como son: C. holmii,
C. norvergiensis, C.auris, C. incospicua, C. fabianii, C.
stellatoidea.
Figura
3.
Mediana de la frecuencia de presentación de cuatro de las especies más
frecuentes en los países y regiones de Latinoamérica.
Resistencia
antifúngica en las especies más frecuentes
La mayoría
de los estudios que reportaron un análisis de sensibilidad a antifúngicos,
evaluaron a los antimicóticos triazólicos (n = 33), seguido por los poliénicos
(n = 29), las equinocandidas (n = 15) y por último las pirimidinas fluoradas (n
= 6). Asociado a esto, predominaron los métodos estandarizados de microdilución
en caldo basados en las recomendaciones del Clinical and Laboratory
Standards Institute (CLSI) y en menor medida los recomendados por European
Committee on Antimicrobial Susceptibility Testing (EUCAST-AFST) (n=2). Le
siguen los métodos comerciales (n=14) tales como: Vitek 2® (basado en la
microdilución en placas siguiendo recomendaciones del CLSI) y E-test®
(difusión en agar con tiras impregnadas en gradiente de concentración
antifúngico siguiendo recomendaciones del CLSI) entre otros.
Resistencia
a antifúngicos triazólicos
La mayoría
de los trabajos evaluaron la susceptibilidad de Candida sp. al fluconazol
(n = 32), seguido por el voriconazol (n = 23) y el itraconazol (n = 12). En
menor proporción se encontró el posaconazol. De estos antimicóticos, la
resistencia al fluconazol es lo más llamativo lo que se puede notar en las
Figuras 4 y 5 con las medianas de las frecuencias de resistencia y de sensible
dosis dependiente (SDD).
De forma
global, la mediana de la resistencia al fluconazol en todos los estudios de la
región latinoamericana fue superior en C. glabrata (16.4 %), seguido en
menor medida por C. parapsilosis (5.7 %), C. tropicalis (3.7 %) y
C. albicans (3.4 %). Un orden similar ocurre con las cepas SDD aunque
con una frecuencia superior en la mayoría de los estudios: C. glabrata (83.3
%), C. tropicalis (12.8 %), C. parapsilosis (7.3 %) y C.
albicans (2.9 %) (Figuras 4 y 5).
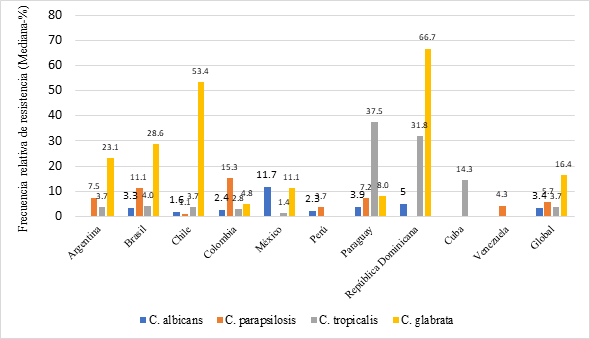
La especie
con mayor resistencia al fluconazol fue C. glabrata con medianas que incluyen
frecuencias entre 4.8 % y 66.7 % del total de aislamientos, exceptuando a Perú,
Cuba y Venezuela. Los países más afectados fueron República Dominicana, Chile, Brasil
y Argentina donde este problema se presenta en más del 20 % de las cepas
aisladas, aunque en el primer caso solo se dispuso de un único estudio (Figura 4).
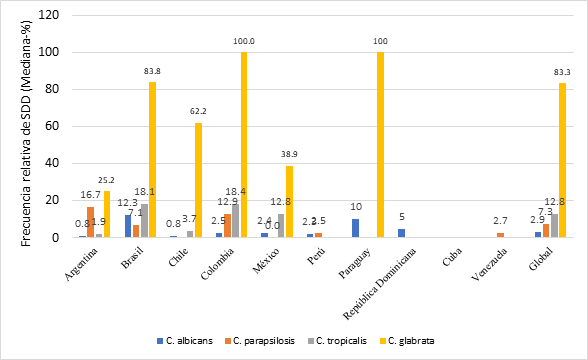
Esto concuerda con la frecuencia de cepas SDD detectadas en 8 países, con
medianas entre el 11.1 % al 100 % con Paraguay, Colombia, Brasil y Chile como
los más afectados (Figura 5).
Por su
parte, en C. parapsilosis, la resistencia se manifestó en siete de los
10 países que reportaron estudios de sensibilidad para esta especie (1.1 %-26.9
%). Colombia fue el más afectado. Por otro lado, las cepas SDD se manifestaron
solo en cinco países con frecuencias entre 2.4 % a 42,1 %, siendo Argentina el
más afectado (mediana de 16.7 %) (Figuras 4 y 5).
La
resistencia de C. tropicalis al fluconazol se detectó en los ocho países
que mostraron estudios de sensibilidad, con medianas que oscilan 1.4 % a 37,5
%. Los países más afectados fueron Paraguay y República Dominicana (Figura 4).
Se suma a esto que la SDD, se reportó en cinco países con una incidencia de
entre 1.0 % a 35.7 %. Colombia y Brasil, son los países con la mayor frecuencia
(Figura 5).
De los nueve
países que evaluaron la susceptibilidad de C. albicans al fluconazol, en
siete se detectó resistencia, con frecuencias que oscilan entre 1.4 % a 17.4 %,
siendo México el más afectado. A esto se suma que en ocho países se detectaron
cepas SDD con porcentajes entre 0.8 % y 15.4 % con Brasil como el más afectado.
Figura 4.Mediana de la frecuencia
de resistencia a Fluconazol en los diferentes países de Latinoamérica.
Figura
5.
Mediana de la frecuencia de SDD a Fluconazol en los diferentes países de
Latinoamérica.
Por otro
lado, la resistencia al Voriconazol se observó en un menor número de países.
Para C. albicans, la frecuencia de resistencia fue menor o igual al 6 %
de los aislamientos y las cepas SDD fue inferior al 4 %. Con C. parapsilosis,
las frecuencias fueron menores al 3 % y al 13 % respectivamente, y para C.
tropicalis los porcentajes fueron menores al 5 % y a 14 %. En el caso de C.
glabrata, la frecuencia de resistencia fue mayor oscilando en intervalos desde
9.1 % hasta 28.3 %. Algo parecido ocurre con las variantes SDD con porcentajes
entre 4.8 % y 33.3 %.
Por último,
se debe indicar que también se encontraron cepas de C. albicans resistentes
al Itraconazol, en Cuba y México. Mientras, en Brasil, Chile, México y
República Dominicana, se observaron variantes con SDD. En C. parapsilosis,
la resistencia solo se reportó en Chile, mientras que la SDD también se observó
en Cuba y México.
Resistencia
a Anfotericina B
La
frecuencia de resistencia reportada para anfotericina B fue baja en comparación
con los triazoles observándose, además, en pocos países. Así, la resistencia de
C. albicans solo se detectó en dos países, Brasil (3.7 % - 5.6 %) y
México (1.4 % - 6.0 %). En el caso de C. parapsilosis, en solo dos
reportes de Brasil con un 5 % y Perú con 7 % respectivamente. En Cuba se
detectaron cepas SDD de C. tropicalis (28.5 % de aislamientos de un
estudio). Por último, la especie C. glabrata es la que mayores porcentajes
de resistencia mostró para este antifúngico (4.8 % a 50 %), aunque solo en dos
países (Brasil y México).
Resistencia
a las equinocandinas
Los estudios
de sensibilidad para estos antifúngicos se reportaron solo para seis países y
dos trabajos multinacionales. En el caso de la anidulafungina, C. glabrata
fue la especie con mayor frecuencia de resistencia reportada: 11.1 % en México,
12.5 % en Perú y 20 % en Colombia; en cuanto a las SDD, se observó en Brasil
(62.5 %), Colombia (40 % a 60 %) y en un estudio multinacional (4.8 %). En el
caso de C. albicans, se detectó resistencia en un trabajo de Chile (0.8
%) y otro de Perú (1.6 %); mientras que las cepas SDD se observaron además en
Colombia (2.5 % - 66.7 %). Por otro lado, se observaron cepas resistentes de C.
parapsilosis en un trabajo de México (2.4 %) y las SDD en Colombia (0.8 %).
En C. tropicalis, la resistencia se presentó en un reporte de Perú (5.6
%) y en dos investigaciones multinacionales se reportaron cepas SDD (1.7 % a
2.3 %).
La
resistencia a Caspofungina solo se reportó en Colombia (1.7 %) para C.
albicans, en México (0.8 %) y Venezuela (0.6 %) para C. parapsilosis,
y para C. glabrata solo en México (11.1 %). Por su parte, la resistencia
a Micafungina solo se observó en México para C.
parapsilosis (3.1 %) y para C. glabrata en Brasil (62.5 %), Chile
(10 %) y México (11.1 %). Las frecuencias de cepas SDD para este
antifúngico fueron pequeñas, afectando solo a C. albicans en Chile (2.3
%).
Resistencia
a la flucitosina
Similar a la
Anfotericina B, tanto la frecuencia de resistencia como los países afectados,
son pocos. La resistencia de C. albicans a este compuesto solo se ha
reportado en un estudio en México (3.6 %) así como la SDD (2.4 %). En el caso
de C. parapsilosis, este problema solo se observó en un estudio en
Brasil (9 % de cepas resistentes), mientras que C. tropicalis en un
trabajo de México (2.6 %) y en Brasil un 26.7 % de cepas SDD también en un solo
reporte.
DISCUSIÓN
Frecuencia
y distribución de especies de Candida sp. en infecciones invasivas.
El
predominio de especies de Candida sp. no albicans encontradas en
este trabajo en los países de Latinoamérica ya se había notado previamente por
otros autores (Colombo et al., 2006; da Matta et al.,
2017; Girao et al., 2008; González et al., 2008; Mesa et al., 2005; Nishikaku
et al., 2010). Esto sugiere que, si bien C. albicans es la
especie predominante a nivel individual en la mayoría de los países de la
región, epidemiológicamente hablando, existe una elevada carga de otras
especies.
Al comparar
el presente estudio con la más reciente revisión sistemática realizada en la
región, se observa una leve tendencia a disminuir la frecuencia de C.
albicans, de 41.4 % a 39 % (da Matta et al.,
2017). Esta observación es resaltada ya desde hace algunos años por
varios autores a nivel mundial. De esta forma Pfaller et al. (Pfaller et al., 2005, 2010, 2019) en el Programa
SENTRY reportan una disminución global desde el 57.4 % en el periodo 1997-2001,
a 46.7 % en 2015-2016. En el caso de Latinoamérica la frecuencia de C.
albicans disminuyó de 51.8 % en el reporte global de 2010 del Programa
SENTRY (Pfaller et al., 2010), a 43.9 % en el
de 2019 (Pfaller et al., 2019). Asimismo, esto
es consistente con estudios puntuales en México (González
et al., 2008), y en Venezuela, con los trabajos de Calvo et al. (Calvo et al., 2010) y Mesa et al. (Mesa et al., 2005) realizados en un mismo hospital
con cinco años de diferencia.
Todo esto
concuerda con la hipótesis de que, en Latinoamérica, al igual que en otras
regiones del mundo, existe una tendencia a la transición epidemiológica en la
que las variantes C. no albicans son cada vez más frecuentes en
los aislamientos de pacientes con candidiasis invasivas. Entre estas especies,
las más frecuentes resultan tres, que en orden son: C. parapsilosis, C.
tropicalis y C. glabrata. En conjunto estas cepas representan casi
el 80 % del total de las especies no albicans, valor cercano al reportado
por Pfaller et al. (Pfaller et al., 2019) de
86 %, pero superior al mostrado en 2010 por el mismo autor (Pfaller et al., 2010).
A pesar de lo
anterior, se debe considerar el impacto que podrían tener la diferente
sensibilidad de los sistemas de detección e identificación de las especies de Candida
sp. empleados en cada estudio, los cuales han variado con el tiempo. Entre
estos se destacan los métodos bioquímicos manuales o automatizados, así como
MALDI-TOF/MS y otros más específicos como los moleculares. La concordancia y
capacidad discriminativa entre estos métodos varía mucho, siendo en algunos
casos inferior al 90 % (Zhao et al., 2018; Zuluaga et
al., 2018).
Resistencia
antifúngica
La
resistencia al fluconazol fue la observación más frecuente en los estudios de
la región, lo que concuerda con el hecho de ser antifúngicos de primera línea. Se
destacan las cepas de C. glabrata, seguida en menor medida por de C.
parapsilosis, C. tropicalis y C. albicans con contrastes
notorios entre los diferentes países de la región. Esta observación no se
reportó previamente con la revisión de Da Matta et al., (da Matta et al., 2017) donde se muestra resistencia en unos
pocos estudios para estas tres últimas especies, pero no para C. glabrata.
Esto sugiere una evolución relativamente rápida para esta resistencia que debe
estudiarse más a profundidad.
De igual
modo, otras investigaciones realizadas en la región no concuerdan completamente
con los presentados en este trabajo, variando significativamente de un reporte
a otro y entre años. En este sentido, en un estudio multinacional SENTRY desde
2006 a 2016, se observó que la resistencia en Latinoamérica para el fluconazol
era relativamente baja. De tal forma, al excluir a C. krusei, que se
conoce que posee una resistencia intrínseca al fluconazol (Jamiu et al., 2021), la especie de C.
parapsilosis fue la que mayor frecuencia de resistencia presentó con 4.3 %,
seguida por C. glabrata (2.6 %), C. tropicalis (1.1 %) y C.
albicans (0.1 %) (Pfaller et al., 2019).
Estos los resultados contrastan con los presentados por los mismos autores años
antes para el periodo 2001-2007 donde las especies resistentes de C.
glabrata (15.1%), C. tropicalis (2.6 %) tenían una incidencia mayor
no así las de C. parapsilosis (2.1 %) (Pfaller
et al., 2010).
Por otro
lado, la presencia de cepas resistentes al voriconazol no había sido
previamente reportada en los estudios multicéntrico de Godoy et al., (Godoy et al., 2003) o por Hazen et al. (Hazen et al., 2003) en cuatro y en siete países de
la región respectivamente. No obstante, sí fue manifestado por da Matta et al. (da Matta et al., 2017) aunque con una frecuencia inferior
al obtenido en el presente estudio. Esto podría sugerir una tendencia al
aumento de la frecuencia de cepas resistentes a este antifúngico, aunque es
algo que debe estudiante más a profundidad porque los reportes fueron escasos.
El otro
resultado llamativo es la resistencia a las equinocandinas, con frecuencias que
en varios estudios superó el 10 % de los aislamientos de algunas de las
especies más frecuentes en la región, en especial para C. glabrata. Así,
los intervalos reportados en el presente trabajo son mayores a los presentados
previamente por da Matta el al. (da Matta et al.,
2017) y a los indicados en el estudio multinacional SENTRY hasta
el 2016 (Pfaller et al., 2019).
En la región
hay escasos estudios que evalúen la resistencia de Candida sp. a las
equinocandinas a pesar de que algunos autores denotan preocupación por el
aumento en el uso de estos antifúngicos. Así, en el periodo de 1999 a 2006, el
consumo de caspofungina aumentó más de 10 veces, (Girao
et al., 2008), lo que también se observó en estudios más recientes entre
los periodos 2010-2011 y 2017-2018 donde el uso de estos compuestos pasó del
13.6 % de los pacientes con candidemias a 41.3 % (González
et al., 2008). Esto podría ser un elemento incidente en el aumento de
cepas resistentes a través mecanismos de selección natural (Toda et al., 2019).
Por otro
lado, los resultados sugieren que, si bien en la región circulan cepas con
mecanismos de resistencia a la anfotericina B, su incidencia no es generalizada
sino localizada en unos pocos países. Esto concuerda con la revisión del tema
realizada por Sales de Oliveira et al., (Oliveira et
al., 2020) quien indica que la resistencia a este antifúngico es rara. Asimismo,
este problema no se observó previamente ni en la investigación multinacional de
Godoy et al. (Godoy et al., 2003) y ni en el
estudio multicéntrico de Colombo et al. (Colombo et
al., 2006) en Brasil, mientras que en el trabajo multicéntrico de
González et al. (González et al., 2008) en
México la única especie afectada fue C. glabrata. En otras regiones o
países, los reportes y niveles de resistencia a este antifúngico también son
bajos (Adam et al., 2021; Bassetti et al., 2019;
Caggiano et al., 2015; Yılmaz-Ciftdo gan et al., 2021).
La
frecuencia de resistencia a flucitosina en aislamientos de candidiasis
invasivas reportados en la región latinoamericana fue también baja. En el
trabajo multinacional de Godoy et al. (Godoy et al.,
2003) ya se había observado que la resistencia a la 5-flucitosina era un
evento raro, identificándose solo un aislamiento en la especie C. albicans.
Así, los estudios multicéntricos posteriores realizados en Brasil y Argentina reafirmaron
esta observación en la región para C. albicans, y adicionaron otras
especies como C. tropicalis, C. parapsilosis y C. glabrata.
Esta observación también se reporta en otros países y regiones del mundo, como
en China (Zeng et al., 2020), e India (Chakraborty et al., 2021).
Lo
presentado hasta el momento sugiere que la resistencia a 5-flucitosina es un
rasgo raro entre las especies de Candida sp. Sin embargo, se ha
observado que después de introducir una monoterapia con este antifúngico
aparecen rápidamente cepas resistentes (Tortorano et
al., 2021). Por ejemplo, el uso en pacientes con candidiasis urinaria
resultó en un aumento de 22 % de signos de resistencia y fallo en la terapia
indicada (Sigera &
Denning, 2023). Con todo esto se podría pensar que este fármaco
no se emplea con mucha frecuencia en monoterapia y por eso la baja frecuencia de
resistencia reportada en los estudios consultados en esta revisión sistemática,
pero no se tienen datos que avalen esta hipótesis.
Limitaciones
metodológicas del estudio
En el
presente estudio resalta la heterogeneidad de métodos para identificar las
cepas resistentes a los antifúngicos evaluados. Entre estos se mencionan desde
metodologías estandarizadas y recomendadas por el CLSI (microdilución en
caldo, difusión en placa E-test®) y por EUCAST, así como algunas
variantes comerciales. Esto es importante a considerar porque la concordancia
entre estos métodos varía lo suficiente como para incidir en la frecuencia de
resistencia reportada en la región.
Como ejemplo
de esto, un trabajo realizado en la región latinoamericana resalta que en
cuanto a los métodos de microdilución en caldo y el método comercial de
difusión en placa E-test® sugeridos por el CLSI podrían haber
diferencias significativas, al menos para algunos antifúngicos. Así, al evaluar
las principales especies reportadas en este estudio, el porcentaje de acuerdos
en el diagnóstico y determinación de las concentraciones inhibitorias mínimas
estuvo entre 76.5 % y 100 %, siendo C. parapsilosis en la que se observó
mayor desacuerdo para la Anidulafungina. En el caso de la Caspofungina el
acuerdo estuvo entre 40 % y 100 % siendo C. glabrata la de mayor
desacuerdo (Berrio et al., 2018). Algo
parecido ha sucedido con otros métodos comerciales como el ATB FUNGUS 3 (Calderón Morales &
Vargas, 2021).
Por otro
lado, las diferencias en puntos de corte a través de los años también impactan
sobre las frecuencias de resistencia reportadas en la región. Así, por ejemplo,
un estudio indica diferencias significativas al utilizar el método de
microdilución en caldo del CLSI con puntos de corte de M27-A3 y M27-S4 (dos Santos et al., 2014). Estas discrepancias
también fueron reportadas por otros autores de la región latinoamericana en
especial para el fluconazol en C. tropicalis y C. glabrata (Sanabria et al., 2014).
Además de lo
presentado anteriormente, la constitución heterogénea de la muestra de
artículos incluidos, limita significativamente el alcance del presente estudio
y que no pueda realizarse un metanálisis para obtener resultados más robustos y
contrastables. En ello influye el hecho de incluir trabajos con diseños muy
diferentes, tanto retrospectivos, prospectivos y transversales, que difieren
significativamente en sus niveles de evidencia y sesgos potenciales (García Villar, 2015).
Por último,
recalcar que la mayoría de los estudios provienen de Sudamérica (especialmente
de Brasil), con escasos trabajos de Centroamérica y de las islas del Caribe.
Por ello, el análisis que se pueda establecer estaría muy afectado por las
características epidemiológica de los países más representados. A esto se
agrega que aproximadamente un 30 % del total de estudios tenían tamaños de
muestra inferiores a 100 aislamientos, lo que podría afectar la identificación
de especies menos frecuentes.
CONCLUSIONES
La
frecuencia de candidiasis invasivas en la región se encuentra entre valores
reportados históricamente. Sin embargo, la frecuencia de Candida albicans
al parecer ha sido inferior a años anteriores para la región, indicando un
posible aumento de especies C. no albicans. Entre estas últimas resaltan
C. parapsilosis, C. tropicalis y C. glabrata, con
diferencias notables entre países de Latinoamérica, lo que indica un panorama
epidemiológico complejo para estos microorganismos.
La
frecuencia de resistencia a los antimicóticos más utilizados en la región
resalta para C. glabrata, especie de la que se reportaron cepas
resistentes o susceptibles dependientes de la dosis en múltiples estudios, con
frecuencias que superan el 50 % de sus aislamientos en varios de ellos. Entre
los antifúngicos con mayor frecuencia de resistencia se encuentran los
triazólicos (fluconazol y voriconazol), seguido de las equinocandinas, la
flucitosina y la anfotericina B. Asimismo, se reporta en la región a la
presencia de la especie multirresistente C. auris, aunque en
proporciones bastante bajas.
Los
resultados de este estudio deben tomarse fundamentalmente como descriptivos y
orientadores de nuevos trabajos que se enfoquen en un verdadero sistema de
vigilancia epidemiológica a nivel regional, con métodos de referencia para
delimitar las especies más frecuentes y su sensibilidad antifúngica. Esto
permitiría tener datos más precisos de tendencias regionales, así como de
establecer y evaluar el impacto de políticas más eficaces para el uso de estas
sustancias.
REFERENCIAS
BIBLIOGRÁFICAS
Adam, K. M., Osthoff, M., Lamoth,
F., Conen, A., Erard, V., Boggian, K., Schreiber, P. W., Zimmerli, S., Bochud,
P. Y., Neofytos, D., Fleury, M., Fankhauser, H., Goldenberger, D., Mühlethaler,
K., Riat, A., Zbinden, R., Kronenberg, A., Quiblier, C., Marchetti, O., … Zbinden, R. (2021).
Trends of the epidemiology of Candidemia in Switzerland: A 15-year FUNGINOS
survey. In Open Forum Infectious Diseases (Vol. 8, Issue 10). Oxford
University Press.
https://doi.org/10.1093/ofid/ofab471
Agnelli, C., Guimarães, T.,
Sukiennik, T., Lima, P. R. P., Salles, M. J., Breda, G. L., Queiroz-Telles, F.,
Chaves Magri, M. M., Mendes, A. V., Camargo, L. F. A., Morales, H., de Carvalho
Hessel Dias, V. M., Rossi, F., & Colombo, A. L. (2023). Prognostic Trends
and Current Challenges in Candidemia: A Comparative Analysis of Two Multicenter
Cohorts within the Past Decade. Journal
of Fungi, 9(4).
https://doi.org/10.3390/jof9040468
Aguilar,
G., Araujo, P., Lird, G., Insaurralde, S., Kawabata, A., Ayala, E., Irala, J.,
& Argüello, R. (2020). Identification
and susceptibility profile of Candida species isolated from hemocultures in
hospitals in Paraguay. Revista
Panamericana de Salud Publica/Pan American Journal of Public Health, 44(1). https://doi.org/10.26633/RPSP.2020.34
Araújo Paulo de Medeiros, M.,
Vieira de Melo, A. P., de Oliveira Bento, A., Ferreira Canário de Souza, L. B.,
de Assis Bezerra Neto, F., Bow Ltaif Garcia, J., Zuza-Alves, D. L., Francisco,
E. C., Salles de Azevedo Melo, A., & Maranhão Chaves, G. (2019). Epidemiology and
prognostic factors of nosocomial candidemia in Northeast Brazil: A six-year
retrospective study. PLoS
ONE, 14(8),
e0221033. https://doi.org/10.1371/journal.pone.0221033
Bassetti, M., Giacobbe, D. R., Vena, A., Trucchi, C.,
Ansaldi, F., Antonelli, M., Adamkova, V., Alicino, C., Almyroudi, M. P.,
Atchade, E., Azzini, A. M., Carannante, N., Carnelutti, A., Corcione, S.,
Cortegiani, A., Dimopoulos, G., Dubler, S., García-Garmendia, J. L., Girardis,
M., … Montravers,
P. (2019). Incidence and outcome of invasive candidiasis in intensive care
units (ICUS) in Europe: Results of the EUCANDICU project. Critical Care,
23(1).
https://doi.org/10.1186/s13054-019-2497-3
Berrio, I., Maldonado, N., De
Bedout, C., Arango, K., Cano, L. E., Valencia, Y., Jiménez-Ortigosa, C.,
Perlin, D. S., Gómez, B. L., Robledo, C., & Robledo, J. (2018). Comparative
study of Candida spp. isolates: Identification and echinocandin susceptibility
in isolates obtained from blood cultures in 15 hospitals in Medellín, Colombia.
Journal of Global Antimicrobial Resistance, 13, 254–260. https://doi.org/10.1016/j.jgar.2017.11.010
Bonfietti, L. X., Szeszs, M. W.,
Chang, M. R., Martins, M. A., Pukinskas, S. R. B. S., Nunes, M. O., Pereira, G.
H., Paniago, A. M. M., Purisco, S. U., & Melhem, M. S. C. (2012). Ten-Year
Study of Species Distribution and Antifungal Susceptibilities of Candida
Bloodstream Isolates at a Brazilian Tertiary Hospital. Mycopathologia, 174(5–6),
389–396.
https://doi.org/10.1007/s11046-012-9566-3
Breda, G. L., Tuon, F. F., Meis, J.
F., Herkert, P. F., Hagen, F., De Oliveira, L. Z., De Carvalho Dias, V., Arns
Da Cunha, C., & Queiroz-Telles, F. (2018). Breakthrough candidemia after the
introduction of broad spectrum antifungal agents: A 5-year retrospective study.
Medical Mycology, 56(4), 406–415. https://doi.org/10.1093/mmy/myx077
Bustamante, B., Martins, M. A., Bonfietti, L. X.,
Szeszs, M. W., Jacobs, J., Garcia, C., & Melhem, M. S. C. (2014). Species distribution and
antifungal susceptibility profile off Candida isolates from bloodstream
infections in Lima, Peru. Journal
of Medical Microbiology,
63(PART 6), 855–860. https://doi.org/10.1099/jmm.0.071167-0
Caggiano, G., Coretti, C., Bartolomeo, N., Lovero, G.,
De Giglio, O., & Montagna, M. T. (2015). Candida bloodstream infections in
Italy: Changing epidemiology during 16 years of surveillance. BioMed
Research International, 2015(ID 256580), 1–9. https://doi.org/10.1155/2015/256580
Calderón Morales, R., & Vargas,
S. G. (2021). Validación
del método comercial ATB FUNGUS 3 frente al método de referencia M27-A2, para
determinar la susceptibilidad de Candida albicans a diferentes antifúngicos. Con-Ciencia:
Revista de Ciencias Farmacéuticas y Bioquímicas, 9(1). https://doi.org/https://doi.org/10.53287/ryhm2292ui11q
Calvo, B., Mesa, A., Pineda, M.,
& Beltrán-Luengo, H. (2010). Cambios en la distribución de especies
deCandidaaisladas de hemocultivos, en pacientes del ServicioAutónomo Hospital
Universitario de Maracaibo,Venezuela. Kasmera, 38(2), 106–117.
http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0075-52222010000200003
Chakraborty, M., Banu, H., &
Kumar Gupta, M. (2021). Epidemiology and Antifungal Susceptibility of Candida
Species. Journal of The Association of Physicians of India, 69,
33–36. https://doi.org/10.13140/RG.2.2.32189.18400
Colombo, A. L., Garnica, M., Aranha
Camargo, L. F., Da Cunha, C. A., Bandeira, A. C., Borghi, D., Campos, T.,
Senna, A. L., Valias Didier, M. E., Carvalho Dias, V., & Nucci, M. (2013). Candida
glabrata: An emerging pathogen in Brazilian tertiary care hospitals. Medical
Mycology, 51(1), 38–44. https://doi.org/10.3109/13693786.2012.698024
Colombo, A. L., Guimarães, T.,
Sukienik, T., Pasqualotto, A. C., Andreotti, R., Queiroz-Telles, F., Nouér, S.
A., & Nucci, M. (2014). Prognostic factors and historical trends in the
epidemiology of candidemia in critically ill patients: an analysis of five
multicenter studies sequentially conducted over a 9-year period. Intensive
Care Medicine, 40(10), 1489–1498.
https://doi.org/10.1007/s00134-014-3400-y
Colombo, A. L., Nucci, M., Park, B.
J., Nouér, S. A., Arthington-Skaggs, B., Da Matta, D. A., Warnock, D., &
Morgan, J. (2006). Epidemiology of candidemia in Brazil: A nationwide sentinel
surveillance of candidemia in eleven medical centers. Journal of Clinical
Microbiology, 44(8), 2816–2823. https://doi.org/10.1128/JCM.00773-06
Cortés, J. A., Montañez, A. M.,
Carreño-Gutiérrez, A. M., Reyes, P., Gómez, C. H., Pescador, A., Ariza, B.,
& Rosso, F. (2021). Risk
factors for mortality in Colombian patients with candidemia. Journal of
Fungi, 7(6), 442–452. https://doi.org/10.3390/jof7060442
Cortés, J. A., Reyes, P., Gómez, C.
H., Cuervo, S. I., Rivas, P., Casas, C. A., & Sánchez, R. (2014). Clinical and
epidemiological characteristics and risk factors for mortality in patients with
candidemia in hospitals from Bogotá, Colombia. Brazilian Journal of
Infectious Diseases, 18(6), 631–637. https://doi.org/10.1016/j.bjid.2014.06.009
Corzo-Leon, D. E., Alvarado-Matute,
T., Colombo, A. L., Cornejo-Juarez, P., Cortes, J., Echevarria, J. I.,
Guzman-Blanco, M., Macias, A. E., Nucci, M., Ostrosky-Zeichner, L.,
Ponce-de-Leon, A., Queiroz-Telles, F., Santolaya, M. E., Thompson-Moya, L., Tiraboschi,
I. N., Zurita, J., & Sifuentes-Osornio, J. (2014). Surveillance of Candida
spp bloodstream infections: Epidemiological trends and risk factors of death in
two Mexican tertiary care hospitals. PLoS ONE, 9(5). https://doi.org/10.1371/journal.pone.0097325
da Matta, D. A., Remondi Souza, A. C., & Lopes
Colombo, A. (2017). Revisiting
species distribution and antifungal susceptibility of candida bloodstream
isolates from latin american medical centers. In Journal of Fungi (Vol.
3, Issue 2, pp. 24–37). MDPI AG. https://doi.org/10.3390/jof3020024
Dias Hoffmann-Santos, H., Rodrigues
Paula, C., Akeme Yamamoto, A. C., Tadano, T., & Hahn, R. C. (2013). Six-Year Trend Analysis
of Nosocomial Candidemia and Risk factors in Two Intensive Care Hospitals in
Mato Grosso, Midwest Region of Brazil. Mycopathologia, 176(5–6),
409–415. https://doi.org/10.1007/s11046-013-9705-5
Doi, A. M., Campos Pignatari, A.
C., Edmond, M. B., Rodrigues Marra, A., Aranha Camargo, L. F., Andreotti
Siqueira, R., Pereira Da Mota, V., & Lopes Colombo, A. (2016). Epidemiology
and microbiologic characterization of nosocomial candidemia from a Brazilian
national surveillance program. PLoS
ONE, 11(1).
https://doi.org/10.1371/journal.pone.0146909
dos
Santos, E. R., Dal Forno, C. F., Hernandez, M. G., Felli Kubiça, T., Venturini,
T. P., Chassot, F., Santurio, J. M., & Hartz Alves, S. (2014). Suscetibilidade de
Candida spp. isoladas de hemocultivos, Avaliadas pelos breakpoints dos
documentos M27-A3 e M27-S4 do CLSI. Revista Do Instituto de Medicina
Tropical de Sao Paulo, 56(6), 477–480.
https://doi.org/10.1590/S0036-46652014000600004
Gaona-Flores, V. A.,
Campos-Navarro, L., Cervantes-Tovar, R., & Alcalá-Martínez, E. (2016). The epidemiology of
fungemia in an infectious diseases hospital in mexico city: A 10-year
retrospective review. Medical
Mycology,
54(6), 600–604. https://doi.org/10.1093/mmy/myw017
García Gómez, D., Abreu Duarte, R.,
Mesa Coello, L., López Pérez, M., & Adjudah Truffín, C. (2020). Situación
actual de la candidiasis sistémica en pacientes hospitalizados. Acta Médica
Del Centro, 14(2). http://scielo.sld.cu/pdf/amdc/v14n2/2709-7927-amdc-14-02-182.pdf
Gevezier da Costa, V., Borsato Quesada, R. M., Stipp
Abe, A. T., Furlaneto-Maia, L., & Furlaneto, M. C. (2014). Nosocomial Bloodstream
Candida Infections in a Tertiary-Care Hospital in South Brazil: A 4-Year
Survey. Mycopathologia, 178(3–4), 243–250.
https://doi.org/10.1007/s11046-014-9791-z
Girao, E., Levin, A. S., Basso, M.,
Gobara, S., Gomes, L. B., Medeiros, E. A. S., & Costa, S. F. (2008). Seven-year
trend analysis of nosocomial candidemia and antifungal (fluconazole and
caspofungin) use in Intensive Care Units at a Brazilian University Hospital. Medical
Mycology, 46(6), 581–588. https://doi.org/10.1080/13693780802004996
Godoy, P., Tiraboschi, I. N.,
Carlos Severo, L., Bustamante, B., Calvo, B., Paula de Almeida, L., Archimedes
da Matta, D., & Lopes Colombo, A. (2003). Species Distribution and
Antifungal Susceptibility Profile of Candida spp. Bloodstream Isolates from
Latin American Hospitals. Mem Inst Oswaldo Cruz, 98(3), 401–405.
https://www.scielo.br/j/mioc/a/DZ6HgZPJtf6Bb3XrggN8GDb/?format=pdf
González, G. M., Elizondo, M.,
& Ayala, J. (2008). Trends
in species distribution and susceptibility of bloodstream isolates of Candida
collected in Monterrey, Mexico, to seven antifungal agents: Results of a 3-year
(2004 to 2007) surveillance study. Journal of Clinical Microbiology, 46(9),
2902–2905. https://doi.org/10.1128/JCM.00937-08
González, G. M., Treviño-Rangel, R.
de J., Palma-Nicolás, J. P., Martínez, C., Lez, J. G. G., Ayala, J., Caballero,
A., Morfín-Otero, R., Rodríguez-Noriega, E., Velarde, F., Ascencio, E. P.,
Tinoco, J. C., Vázquez, J. A., Cano, M. A., León-Sicairos, N., Lez, R. G.,
Rincón, J., Elías, M. A., & Bonifaz, A. (2013). Species distribution and antifungal
susceptibility of bloodstream fungal isolates in paediatric patients in Mexico:
A nationwide surveillance study. Journal of Antimicrobial Chemotherapy, 68(12),
2847–2851. https://doi.org/10.1093/jac/dkt283
González Lorenzo, L., García Gómez,
D., Castro Martínez, J. A., López Pérez, M., Truffín Truffín, E. G., &
González Lorenzo, L. (2023). Comportamiento
de Candida en niños hospitalizados en unidades de cuidados intensivos. Medicentro
Electrónica, 27(1).
http://scielo.sld.cu/pdf/mdc/v27n1/1029-3043-mdc-27-01-e3829.pdf
Guzzetti, L. B., Vescina, C. M., Gil, M. F., &
Gatti, B. M. (2017). Candidemia in Pediatrics: Species distribution and
antifungal susceptibility. Revista Argentina de Microbiologia, 49(4),
320–322. https://doi.org/10.1016/j.ram.2016.12.011
Hazen, K. C., Baron, E. J., Colombo, A. L., Girmenia,
C., Sanchez-Sousa, A., Del Palacio, A., De Bedout, C., Gibbs, D. L.,
Tiraboschi, N., Finquelievich, J., Ellis, D., Frameree, D., Van Den Abeele, A.
M., Rennie, R., Sanche, S., Bijie, H., Xu, Y., Restrepo, A., Vega, R., … Santiago, A. (2003).
Comparison of the susceptibilities of Candida spp. to fluconazole and
voriconazole in a 4-year global evaluation using disk diffusion. Journal of
Clinical Microbiology, 41(12), 5623–5632. https://doi.org/10.1128/JCM.41.12.5623-5632.2003
Herkert, P. F., Rodrigues Gomes,
R., Dominguez Muro, M., Lameira Pinheiro, R., Fornari, G., Vicente, V. A.,
& Queiroz-Telles, F. (2015). In vitro susceptibility and molecular
characterization of Candida spp. from candidemic patients. Revista Iberoamericana de
Micologia,
32(4), 221–228. https://doi.org/10.1016/j.riam.2014.07.007
Jamiu, A. T., Albertyn, J., Sebolai, O. M., &
Pohl, C. H. (2021). Update
on Candida krusei, a potential multidrug-resistant pathogen. In Medical
Mycology (Vol. 59, Issue 1, pp. 14–30). Oxford University Press. https://doi.org/10.1093/mmy/myaa031
Lemus-Espinoza,
D., & Maniscalchi, M. T. (2021). REVISIÓN DEL PERFIL DE SENSIBILIDAD DE LEVADURAS
AISLADAS EN PACIENTES DEL ESTADO ANZOÁTEGUI, VENEZUELA, 2009-2017. Saber,
Universidad de Oriente, Venezuela, 33, 115–121.
https://doi.org/https://doi.org/10.5281/zenodo.5813223
López Moral, L., Tiraboschi, I. N., Schijman, M.,
Bianchi, M., Guelfand, L., & Cataldi, S. (2012). Fungemias en hospitales de la
Ciudad de Buenos Aires, Argentina. Revista Iberoamericana de Micologia, 29(3),
144–149. https://doi.org/10.1016/j.riam.2011.11.001
Márquez, F., Iturrieta, I., Calvo,
M., & Urrutia Patricio Godoy-Martínez, M. (2017). Epidemiología y
susceptibilidad antifúngica de especies causantes de candidemia en la ciudad de
Valdivia, Chile. Revista Chilena de Infectología, 34(5), 441–446.
https://doi.org/http://dx.doi.org/10.4067/S0716-10182017000500441.
Menezes, R. de P., Ferreira, J. C.,
Machado de Sá, W., de Aquino Moreira, T., Silva Malvino, L. D., Borges de
Araujo, L., Von Dolinger de Brito Röder, D., Amante Penatti, M. P., Candido, R.
C., & dos Santos Pedroso, R. (2015). Frequência de espécies de Candida em
hospital terciário do Triângulo Mineiro, Minas Gerais, Brasil. Revista Do
Instituto de Medicina Tropical de Sao Paulo, 57(3), 185–191. https://doi.org/10.1590/S0036-46652015000300001
Mesa, L. M., Arcaya, N. M., Pineda
S., M. R., Beltrán-Luengo, H., & Calvo, B. M. (2005). Candidemia en el
Hospital Universitario de Maracaibo, Estado Zulia, Venezuela 2000-2002. Revista
de La Sociedad Venezolana de Mocrobiología, 25(2), 252–259.
http://www.redalyc.org/articulo.oa?id=199416579010
Mondelli, A. L., Niéro-Melo, L., Bagagli, E., Camargo,
C. H., Bruder-Nascimento, A., Sugizaki, M. F., Carneiro, M. V., & Villas
Boas, P. J. F. (2012). Candidemia
in a Brazilian tertiary hospital: microbiological and clinical features over a
six-year period. The Journal of Venomous Animals and Toxins Including
Tropical Diseases, 18(2), 244–252.
https://doi.org/https://doi.org/10.1590/S1678-91992012000200015
Moreno,
X., Reviákinab, V., Panizob, M. M., Ferrarab, G., Garcíab, N., Alarcónb, V.,
& Dolande, M. (2015). Frecuencia
y perfil de sensibilidad in vitro de aislamientos del Complejo Candida
parapsilosis provenientes de pacientes con candidemias. Revista de La
Sociedad Venezolana de Microbiología, 35, 103–110.
http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S1315-25562015000200008
Moreno-Loaiza, M., &
Moreno-Loaiza, O. (2017). Características clínicas y epidemiológicas de
la candidemia en pacientes de un hospitalde tercer nivel del sur del
Perú, 2011-2014. Acta Med Peru, 34(4), 289–293. https://www.redalyc.org/articulo.oa?id=96654350006
Moretti, M. L., Trabasso, P., Lyra, L., Fagnani, R.,
Resende, M. R., De Oliveira Cardoso, L. G., & Zaninelli Schreiber, A.
(2013). Is
the incidence of candidemia caused by Candida glabrata increasing in Brazil?
Five-year surveillance of Candida bloodstream infection in a university
reference hospital in southeast Brazil. Medical Mycology, 51(3),
225–230. https://doi.org/10.3109/13693786.2012.708107
Motoa,
G., Muñoz, J. S., Oñate, J., Pallares, C. J., Hernández, C., & Villegas, M.
V. (2017). Epidemiología
de aislamientos de Candida en unidades de cuidados intensivos en Colombia
durante el período 2010–2013. Revista
Iberoamericana de Micologia,
34(1), 17–22. https://doi.org/10.1016/j.riam.2016.02.006
Munn, Z., Barker, T., Moola, S., Tufanaru, C., Stern,
C., McArthur, A., Stephenson, M., & Aromataris E. (2020). Methodological quality
of case series studies: an introduction to the JBI critical appraisal tool. JBI
Evidence Synthesis. . JBI Evidence Synthesis, 18(10), 2127–2133.
Nucci, M., Queiroz-Telles, F.,
Alvarado-Matute, T., Tiraboschi, I. N., Cortes, J., Zurita, J., Guzman-Blanco,
M., Santolaya, M. E., Thompson, L., Sifuentes-Osornio, J., Echevarria, J. I.,
& Colombo, A. L. (2013). Epidemiology of Candidemia in Latin America: A
Laboratory-Based Survey. PLoS
ONE, 8(3),
e59373. https://doi.org/10.1371/journal.pone.0059373
Oliveira, J. S. de, Pereira, V. S.,
Castelo-Branco, D. de S. C. M., Cordeiro, R. de A., Sidrim, J. J. C.,
Brilhante, R. S. N., & Rocha, M. F. G. (2020). The yeast, the antifungal, and the
wardrobe: a journey into antifungal resistance mechanisms of Candida
tropicalis. Canadian
Journal of Microbiology,
66(6), 377–388. https://doi.org/10.1139/cjm-2019-0531
Page, M. J., McKenzie, J. E.,
Bossuyt, P. M., Boutron, I., Hoffmann, T. C., Mulrow, C. D., Shamseer, L.,
Tetzlaff, J. M., Akl, E. A., Brennan, S. E., Chou, R., Glanville, J., Grimshaw,
J. M., Hróbjartsson, A., Lalu, M. M., Li, T., Loder, E. W., Mayo-Wilson, E.,
McDonald, S., … Moher,
D. (2021). The PRISMA 2020 statement: An updated guideline for reporting
systematic reviews. In The BMJ (Vol. 74, Issue 9, pp. 790–799). BMJ
Publishing Group.
https://doi.org/10.1136/bmj.n71
Pappas, P. G., Lionakis, M. S.,
Arendrup, M. C., Ostrosky-Zeichner, L., & Kullberg, B. J. (2018). Invasive
candidiasis. Nature Reviews Disease Primers, 4.
https://doi.org/10.1038/nrdp.2018.26
Pfaller, M. A., Diekema, D. J.,
Gibbs, D. L., Newell, V. A., Ellis, D., Tullio, V., Rodloff, A., Fu, W., &
Ling, T. A. (2010). Results from the artemis disk global antifungal
surveillance study, 1997 to 2007: A 10.5-year analysis of susceptibilities of
candida species to fluconazole and voriconazole as determined by CLSI
standardized disk diffusion. Journal of Clinical Microbiology, 48(4),
1366–1377. https://doi.org/10.1128/JCM.02117-09
Pfaller, M. A., Diekema, D. J.,
Rinaldi, M. G., Barnes, R., Hu, B., Veselov, A. V., Tiraboschi, N., Nagy, E.,
Gibbs, D. L., Finquelievich, J., Ellis, D., Frameree, D., Van Den Abeele, A.,
Senterre, J. M., Colombo, A., Rennie, R., Sanche, S., Hu, B., Xu, Y., …
Santiago, A. (2005). Results from the ARTEMIS DISK global antifungal
surveillance study: A 6.5-year analysis of susceptibilities of candida and
other yeast species to fluconazole and voriconazole by standardized disk
diffusion testing. Journal of Clinical Microbiology, 43(12),
5848–5859.
https://doi.org/10.1128/JCM.43.12.5848-5859.2005
Pfaller, M. A., Diekema, D. J.,
Turnidge, J. D., Castanheira, M., & Jones, R. N. (2019). Twenty years of
the SENTRY Antifungal Surveillance Program: Results for Candida species from
1997-2016. Open Forum Infectious Diseases, 6, S79–S94. https://doi.org/10.1093/ofid/ofy358
Ramirez Serafín, Y., Larrondo
Muguercia, H., Halley Posada, M. del C., Hidalgo Costa, T., & León Pérez,
D. O. (2013). Revista Cubana de Medicina Intensiva y Emergencias Rev Cub Med
Int Emerg 2013;12(4) TRABAJOS ORIGINALES. Revista Cubana de Medicina
Intensiva y Emergencias, 12(4). https://www.medigraphic.com/pdfs/revcubmedinteme/cie-2013/cie134j.pdf
Riera, F., Medeot, M., Sartori, L., Bergallo, C.,
Minoli, J., Vilchez, V., Sánchez, P., Abiega, C., Pincheira, C., Correa; S.,
Bartoli, C., Figueroa, M., Montamat, M., Spitale, N., Minguez, A., &
Caeiro, J. P. (2014). EPIDEMIOLOGIA
DE CANDIDEMIA EN CORDOBA REPUBLICA ARGENTINA. ESTUDIO DE VIGI-LANCIA DE
CINCO INSTITUCIONES. Revista de La Facultad de Ciencias Médicas, 71(2),
89–93.
https://www.researchgate.net/publication/267755237
Riera, F. O., Caeiro, J. P.,
Angiolini, S. C., Vigezzi, C., Rodriguez, E., Icely, P. A., & Sotomayor, C.
E. (2022). Invasive Candidiasis: Update and Current Challenges in the
Management of This Mycosis in South America. Antibiotics, 11(7). https://doi.org/10.3390/antibiotics11070877
Rocha Braga, P., Cruz, I. L.,
Ortiz, I., Barreiros, G., Nouér, S. A., & Nucci, M. (2018). Secular trends of
candidemia at a Brazilian tertiary care teaching hospital. Brazilian Journal
of Infectious Diseases, 22(4), 273–277. https://doi.org/10.1016/j.bjid.2018.07.008
Rodrigues, D. K. B., Bonfietti, L.
X., Garcia, R. A., Araujo, M. R., Rodrigues, J. S., Gimenes, V. M. F., &
Melhem, M. S. C. (2021). Antifungal
susceptibility profile of Candida clinical isolates from 22 hospitals of São
Paulo State, Brazil. Brazilian Journal of Medical and Biological Research,
54(9). https://doi.org/10.1590/1414-431X2020E10928
Rodriguez, L., Bustamante, B.,
Huaroto, L., Agurto, C., Illescas, R., Ramirez, R., Diaz, A., & Hidalgo, J.
(2017). A
multi-centric study of Candida bloodstream infection in Lima-Callao, Peru:
Species distribution, antifungal resistance and clinical outcomes. PLoS ONE, 12(4),
e0175172. https://doi.org/10.1371/journal.pone.0175172
Salcedo Inoa, N., García Pérez, J.,
Cabrera, S., & Smester, G. (2012). Identificaciony susceptibilidad
antifúngica de Candidas spp. en Hemocultivos de pacientes hospitalizados.
Casuistica 2010, Hospital General Plaza de la Salud. Anuario de
Investigaciones Científicas UASD, 1(1).
Sanabria, R., Samudio, M., Fariña,
N., Laspina, F., Figueredo, L. de, Aguilar, G., & Espínola, C. (2014).
Perfil de susceptibilidad a anti fúngicos de aislados de Candida spp por el
método de microdilución. Nuevos puntos de cortes para fluconazol. Mem. Inst.
Investig. Cienc. Salud, 12(1), 33–40. http://scielo.iics.una.py/scielo.php?script=sci_arttext&pid=S1812-95282014000100006
Santolaya, M. E., Thompson, L.,
Benadof, D., Tapia, C., Legarraga, P., Cortés, C., Rabello, M., Valenzuela, R.,
Rojas, P., & Rabagliati, R. (2019). A prospective, multi-center study
of candida bloodstream infections in Chile. PLoS ONE, 14(3),
e0212924.
https://doi.org/10.1371/journal.pone.0212924
Saúl García, Y., & Hernández
Valles, R. (2013). Aislamiento y susceptibilidad a fluconazol y voriconazol de
especies de Candidaprovenientes de pacientes recluidos en la Unidad de Cuidados
Intensivos, Hospital Universitario de Coro, estado Falcón, Venezuela. Revista
de La Sociedad Venezolana de Microbiología, 33, 140–145.
http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S1315-25562013000200010
Sigera, L. S. M., & Denning, D. W. (2023). Flucytosine and its
clinical usage. In Therapeutic Advances in Infectious Disease (Vol. 10,
pp. 1–15). SAGE Publications Ltd.
https://doi.org/10.1177/20499361231161387
Siri, L., Legarraga, P., García,
P., González, T., & Rabagliati, R. (2017). Cambios clínicos y
epidemiológicos de candidemias en pacientes adultos desde 2000 a 2013. Revista
Chilena de Infectología, 34(1), 19–26. https://doi.org/http://dx.doi.org/10.4067/S0716-10182017000100003
Spina Canela, H. M., Cardoso, B., Vitali, L. H.,
Colares Coelho, H., Martinez, R., & da Silva Ferreira, M. E. (2017). Prevalence, virulence
factors and antifungal susceptibility of Candida spp. isolated from bloodstream
infections in a tertiary care hospital in Brazil. Mycoses, 61(1), 11–21. https://doi.org/10.1111/myc.12695
Tiraboschi, I. N., Pozzi, N. C.,
Farías, L., García, S., & Fernández, N. B. (2017). Epidemiología, especies,
resistencia antifúngica y evolución de las candidemias en un hospital
universitario de Buenos Aires, Argentina, durante 16 años. Revista Chilena
de Infectología, 34(5), 431–440. https://doi.org/http://dx.doi.org/10.4067/S0716-10182017000500431
Toda, M., Williams, S. R., Berkow,
E. L., Farley, M. M., Harrison, L. H., Bonner, L., Marceau, K. M., Hollick, R.,
Zhang, A. Y., Schaffner, W., Lockhart Shawn R., Jackson, B. R., &
Vallabhaneni, S. (2019). Population-Based Active Surveillance for Culture-Confirmed
Candidemia-Four Sites, United States, 2012-2016. MMWR Surveillance Summaries, 68(8), 1–15.
https://doi.org/10.15585/mmwr.ss6808a1
Torres Guerrero, H., Martínez
Espinosa, I., Gonzales Ibarra, M., & Aguirre García, M. (2016). Distribution of Candida
Species and Molecular Typing of C. albicans Isolates in a Mexico City Tertiary
Care Hospital from 2011 to 2013. Open Journal of Medical Microbiology, 06(02),
66–79. https://doi.org/10.4236/ojmm.2016.62010
Tortorano, A. M., Prigitano, A.,
Morroni, G., Brescini, L., & Barchiesi, F. (2021). Candidemia: Evolution of
Drug Resistance and Novel Therapeutic Approaches. In Infection and Drug
Resistance (Vol. 14, pp. 5543–5553). Dove Medical Press Ltd.
https://doi.org/10.2147/IDR.S274872
Vigezzi, C., Icely, P. A., Dudiuk,
C., Rodríguez, E., Miró, M. S., Castillo, G. D. V., Azcurra, A. I., Abiega, C.,
Caeiro, J. P., Riera, F. O., García-Effrón, G., & Sotomayor, C. E. (2019). Frequency, virulence
factors and antifungal susceptibility of Candida parapsilosis species complex
isolated from patients with candidemia in the central region of Argentina. Journal de Mycologie
Medicale,
29(4), 285–291. https://doi.org/10.1016/j.mycmed.2019.100907
Villalobos, J. M., Castro, J. A.,
Avilés, Á., Peláez, M. C., Somogyi, T., & Sandoval, L. (2016). Candida
parapsilosis: principal causa de candidemia en un hospital de referencia para
adultos de Costa Rica. Revista Chilena de Infectología, 33(2),
159–165.
https://www.scielo.cl/pdf/rci/v33n2/art05.pdf
Villalobos-Vindas, J. M.,
Castro-Cordero, J. A., Avilés-Montoya, Á., Peláez-Gil, M. C., Somogyi-Pérez,
T., & Sandoval-Carpio, L. (2016). Epidemiología de la candidemia en el
Hospital México. Acta Médica Costarricence, 58(1), 15–21.
https://www.scielo.sa.cr/scielo.php?script=sci_arttext&pid=S0001-60022016000100015
Villanueva, F., Veliz, J., Canasa,
K., Bellido, E., Martell, S., Ortega, S., & Cajamarca, I. (2020). Characteristics of
fungemias in a peruvian referral center: 5-year retrospective analysis. Revista Peruana de
Medicina Experimental y Salud Publica, 37(2), 276–281. https://doi.org/10.17843/RPMESP.2020.372.5026
Yamin, D., Akanmu, M., Al Mutair,
A., Alhumaid, S., Rabaan, A., & Hajissa, K. (2022). Global Prevalence of
Antifungal-Resistant Candida parapsilosis: A Systematic Review and
Meta-Analysis. . Trop. Med. Infect. Dis., 7(8), 188.
Yılmaz-Ciftdo gan, D., Kara-Aksay,
A., Erbas, G., Bas ak Sarkıs, Ü., Karada g-Oncel, E., Berna Anıl, A., allah
Baran, M., Er, H., & Yılmaz, N. (2021). Epidemiology of Candidemia in
Children over 7 Years in a Medical Center in Turkey. Microbiology Spectrum,
9, e00453-21. https://doi.org/10.1128/Spectrum
Zeng, Z., Ding, Y., Tian, G., Yang,
K., Deng, J., Li, G., & Liu, J. (2020). A seven-year surveillance study of
the epidemiology, antifungal susceptibility, risk factors and mortality of
candidaemia among paediatric and adult inpatients in a tertiary teaching
hospital in China. Antimicrobial Resistance and Infection Control, 9(1),
133. https://doi.org/10.1186/s13756-020-00798-3
Zhao, Y., Tsang, C. C., Xiao, M.,
Chan, J. F. W., Lau, S. K. P., Kong, F., Xu, Y., & Woo, P. C. Y. (2018).
Yeast identification by sequencing, biochemical kits, MALDI-TOF MS and rep-PCR
DNA fingerprinting. Medical
Mycology,
56(7), 816–827. https://doi.org/10.1093/mmy/myx118
Zuluaga, A., Arango-Bustamante, K.,
Caceres, D. H., Sánchez-Quitian, Z. A., Velásquez, V., Gómez, B. L.,
Parra-Giraldo, C. M., Maldonado, N., Cano, L. E., de Bedout, C., & Rivera,
R. E. (2018). Concordance
analysis between different methodologies used for identification of oral
isolates of Candida species. Colombia Medica, 49(3), 193–200. https://doi.org/10.25100/cm.v49i3.3774